Água Dura

Sal insolúvel de cálcio sobre peça de máquina de lavar roupa, formado pela ação da água dura
É denominada de “água dura” todas as águas naturais que possuem cátions cálcio (Ca2+(aq)), magnésio (Mg2+(aq)) e ferro II (Fe2+(aq)). Elas são chamadas assim porque o cozimento de vegetais nesse tipo de água faz com que eles endureçam.
Como acontece em muitas regiões brasileiras, os cátions cálcio e magnésio são provenientes da dissolução de rochas calcárias.
A presença desses cátions impede a ação de limpeza dos sabões. Os sabões são formados por longas cadeias carbônicas apolares e uma extremidade polar, como o exemplo abaixo:
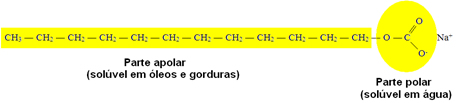
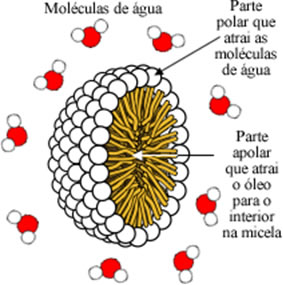
Geralmente, eles são tensoativos porque a sua parte polar interage com a água (que também é polar) e diminui a tensão superficial dela. São também emulsificantes ou surfactantes porque a sua parte apolar interage com as gorduras, criando aglomerações delas. Formam-se micelas esféricas, que são estruturas em que a gordura fica na parte interna atraída pela cadeia apolar e as moléculas de água ficam na parte externa, atraídas pela extremidade polar.
Os ânions formados pelo sabão na água são então uma parte essencial da remoção da sujeira. O estereato de sódio é um sabão, veja o ânion que ele forma:
C17H35COONa(s) → Na+(aq) + C17H35COO1-(aq)
Porém, quando a água é dura, os seus cátions reagem com ânion do sabão, formando um precipitado que é insolúvel. Além de impedir a ação de limpeza, esses precipitados ainda aderem ao tecido que está sendo lavado ou à beira da pia, do tanque, da mangueira etc.
Abaixo temos a reação do cátion cálcio com o ânion do estereato de sódio:
C17H35COO1-(aq) + Ca2+(aq) → (C17H35 ─ COO)2Ca(ppt)
ânion do sabão cátion sal de cálcio
cálcio precipitado
ânion do sabão cátion sal de cálcio
cálcio precipitado
Abaixo temos um exemplo da formação de um sal de cálcio no ralo de uma pia que fica em uma região em que o solo é rico em calcário:

Isso pode representar grandes prejuízos econômicos, principalmente para indústrias, em que tubulações podem entupir, e equipamentos, como as caldeiras, podem estragar.
É possível perceber se a água da torneira de nossa casa é dura se, ao usar o sabão, você não conseguir formar espuma. Os detergentes sintéticos são imunes a esse tipo de inconveniente.
É possível eliminar essa dureza da água por meio de técnicas físicas e químicas. Se os sais que estiverem dissolvidos na água forem bicarbonatos de cálcio, magnésio ou ferro, apenas métodos físicos já são suficientes, tais como uma destilação. Agora se ânions desses sais não forem bicarbonatos, mas sim sulfatos, nitratos ou cloretos, aí será necessário aplicar processos químicos.
Apesar de todo problema e prejuízo que a água dura pode causar, ela possui seu lado positivo, pois constitui uma fonte de cálcio para os dentes e ossos, e estudos indicam que elas possuem vantagens terapêuticas, como a redução da adsorção de gordura e a prevenção de doenças cardíacas.
Por Jennifer Rocha Vargas Fogaça

Nenhum comentário:
Postar um comentário