Água: Substância interessante

A água é uma
substância única: em virtude da sua constituição química, ela possui
características que nenhum outro material na natureza possui
“A Terra é azul!” – essa foi a
exclamação feita no dia 12 de abril de 1961, pelo cosmonauta soviético
Yury Gagarin ao realizar o primeiro voo ao redor da órbita da Terra.
Hoje praticamente todas as pessoas sabem que a quantidade aproximada de
água cobrindo a superfície terrestre é de 70%, ou seja, 1,4 bilhão de
km3 do volume da Terra é constituído de água.
No entanto, mesmo conhecendo bem esse fato, não percebemos no cotidiano
a importância da água para a nossa vida. Além disso, muitos não
conhecem as propriedades interessantes que só a água tem e que fazem com
que esse líquido seja tão precioso.
Mas antes de vermos o que torna a água uma substância tão interessante,
vamos primeiramente conceituar a que estamos nos referindo. Por que
isso é necessário? Basicamente por dois motivos: o primeiro está
relacionado ao fato de haver diferentes significados para ela na
Química. Por exemplo, a água pode ser um material que contém diversas
substâncias dissolvidas (como a água da torneira, a água da chuva, a
água mineral, a água subterrânea, a água do mar, etc.) ou então somente a
substância pura com a fórmula molecular H2O, isto é, suas
moléculas são formadas por dois átomos de hidrogênio ligados a um átomo
de oxigênio (que é o caso da água destilada ou desmineralizada). O
segundo motivo é que só sabendo dessa constituição da água é que
poderemos entender suas características peculiares.
Uma dessas características é o fato de que só a água é encontrada na natureza nos três estados físicos:
nos rios, lagos e mares ela está na forma líquida; na atmosfera,
encontra-se na forma de vapor; e nas calotas polares, está na forma
sólida (gelo).
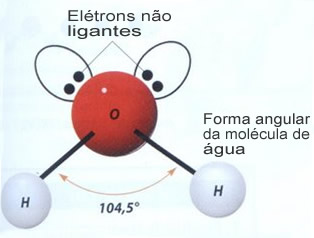
Uma série de propriedades características da água resulta simplesmente da sua geometria molecular,
na qual o ângulo formado é de 104º40’, conforme a figura a seguir. A
forma angular da molécula de água é assim, porque, visto que o oxigênio
possui dois pares eletrônicos que não participam das ligações com os
hidrogênios, eles repelem os outros dois pares eletrônicos que
participam das ligações químicas. Isso faz com que ocorra uma retração
no ângulo da molécula.
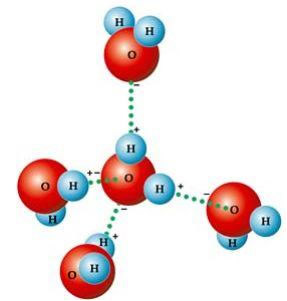
Essa forma angular é a responsável pela formação de ligações de hidrogênio
entre uma molécula de água com as outras que estão ao seu redor. Além
disso, outro fator que ocasiona as ligações de hidrogênio é que a molécula de água é polar,
isto é, há uma diferença de eletronegatividade entre o oxigênio – que
constitui o polo negativo – e os hidrogênios – polos positivos. Pelo
fato de o ângulo ser de 104º40’ na molécula de água, os dipolos da
molécula não se anulam, conferindo polaridade a ela e havendo, portanto,
atração entre uma molécula e as outras.
Essas ligações são responsáveis pela tensão superficial da água, que faz com que os insetos possam se locomover em cima dela. Também são responsáveis pelas elevadas
temperaturas da água em relação a outras substâncias de mesma massa
molecular e também fazem com que o gelo seja menos denso que a água,
flutuando nela.

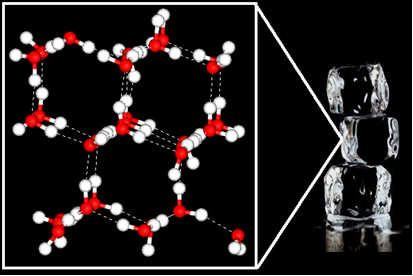
Essa última característica da água é realmente muito interessante, pois
se compararmos com outros materiais, veremos que ao ficarem sólidos sua
densidade fica maior. Já com a água não é assim: quando as moléculas de
água têm a sua temperatura diminuída elas se aproximam mais, e isso faz
com que as ligações de hidrogênio se organizem num arranjo hexagonal,
com uma estrutura cristalina em que há espaços vazios em seu interior. O
resultado é que o gelo é menos denso que a água e flutua sobre ela.
Graças a essa propriedade incomum da água é que ocorre a manutenção da
vida. Pois é por isso que o gelo formado nos lagos e mares ficam na
superfície desses. Quando a temperatura se eleva, eles derretem; mas, se
fosse o contrário, se o gelo fosse mais denso e afundasse, dificilmente
ele derreteria. Além disso, a água atinge sua densidade máxima a 4ºC,
ainda no estado líquido. Assim, quando as águas superficiais atingem
essa temperatura, elas tornam-se mais densas e afundam, causando o
fenômeno de convecção, que mistura os nutrientes dissolvidos à água, que
mantém a vida de inúmeras espécies animais e vegetais.
Outro fator interessante da água que é causado também pelas ligações de hidrogênio é o elevado calor específico
dela (4, 184 J/gºC ou aproximadamente 4,2 joules). A vida na Terra é
extremamente favorecida por essa propriedade da água, pois permite que
ela absorva grandes quantidades de energia com pequenas variações de
temperatura. Isso faz com que a Terra não sofra variações tão bruscas de
temperatura entre o dia e a noite, pois a água da atmosfera e da
superfície absorve grande quantidade de calor durante o dia, e durante a
noite devolve esse calor para o ambiente.
Pelo processo das correntes marítimas e pela evaporação e condensação
da grande quantidade de água na superfície terrestre, o fluxo da energia
térmica absorvida pela radiação solar é facilitado.
A água possui diversos aspectos exclusivos dela, mas um último aspecto
interessante e importante da água que iremos citar é que ela é capaz de dissolver grandes quantidades de substâncias e materiais, sendo, portanto, denominada solvente universal.
Essa facilidade de dissolver diferentes tipos de substâncias também se
deve à geometria e à disposição de suas cargas. A polarização da água
permite que ela separe íons de outras substâncias, o que permite a
ocorrência de diversos processos químicos, físicos e biológicos.
Por Jennifer Rocha Vargas Fogaça

Nenhum comentário:
Postar um comentário